Cicatrización y sus fases. Factores que retardan la cicatrización.
Universidad Autónoma de Chiapas
Facultad de Medicina Campus IV
Docente: Dr. Omar Gómez Cruz
Alumno: Luis Fernando Aguilar Hidalgo
Modulo y Grupo: 3° B
INTRODUCCIÓN
La cicatrización es la reparación de una herida con tejido fibroso mediante un proceso biológico complejo resultado de movimiento, división y síntesis proteica celular, lo cual genera un producto final de tejido no funcional denominado cicatriz. Todo con la finalidad de reparar el tejido lesionado; estos procesos no tienen límites precisos ya que ocurren de manera simultánea y continua.

Hemostasia y fase inflamatoria
Al producirse una herida hay un gran caos de células muertas, así como sangre, cuerpos extraños y algunas bacterias. Esta respuesta que se da es la inflamación y es considerada como la preparación de un sustrato o base orgánica y tisular que tiene como fin la curación y presupone una defensa contra otras lesiones o invasiones futuras, así como también la liberación de factores solubles quimiotácticos que controlan la permeabilidad de los vasos y otros que atraen o atrapan células.
El factor XII, una glucoproteína del plasma, se activa al contacto con la colágena tisular de la lesión y genera bradiquinina, que origina la cascada de factores del complemento activadas por los anticuerpos IgM e IgG ligados a la superficie de los microorganismos o por los liposacáridos bacterianos, una vez activada la fijación del complemento se produce la reacción inflamatoria por liberación de C5 y C9, que se combinan para producir una gran cantidad de complejos proteínicos que median la lisis de las células bacterianas. Los factores del complemento opsonizan y hacen reconocibles a los invasores. En esta fase domina el flujo de elementos hemáticos al sitio de la lesión con la liberación de citocinas y otros mediadores de la inflamación. Los elementos que participan en esta fase son:
- Plaquetas: despues de una herida lo primero que se ve es sangre o hemorragia y en el sitio donde esa sangre coagula es donde las plaquetas quedan atrapadas siendo una parte esencial para detener el sangrado y estimular el proceso de inflamación normal. Liberan fibrinógeno, fibronectinas, trombospondina y factor de von Willebrand. De los elementos que aportan las plaquetas, el más evidente es la fibrina, derivada del fibrinógeno, también denominado factor I. La reacción de fibrinógeno a fibrina es catalizada por la trombina que, a su vez, se deriva de la tromboplastina o factor III.
- Coagulación: la salida de plasma y otros elementos de la sangre desencadenan lo que se llama cascada de la coagulación, que tiene lugar por medio de las vías intrínseca y extrínseca. Las dos conducen a la formación de la trombina, que es la enzima que convierte el fibrinógeno en fibrina y coagula la sangre. El fibrinógeno y los receptores de superficie se ligan y polimerizan para formar la matriz de fibrina y crean el trombo. El coágulo de fibrina no sólo tiene la función de hacer hemostasia, sino que junto con la fibronectina forma el armazón sobre el que migrarán los monocitos, fibroblastos y queratinocitos.
- Leucocitos: con el estímulo de los productos de la cascada de la coagulación, los neutrófilos son las primeras células nucleadas en llegar. Los neutrófilos, una vez en el sitio de la herida y bajo la influencia de las integrinas que se encuentran en su superficie, tienen la función de destruir y englobar a las bacterias, así como a las proteínas que se encuentran en la lesión. Al parecer, los productos de la degradación celular, la trombina y los factores transformadores del crecimiento cumplen una función prominente entre estos estimuladores específicos, y bajo su influjo los monocitos sufren una transformación en su fenotipo para convertirse en macrófagos tisulares que, además, secretan factores de crecimiento, factores de crecimiento de fibroblastos y otras citocinas que son importantes para inducir migración y proliferación celular. Estos macrófagos también participan en la limpieza de la herida. Todos estos procesos de macrófagos y monocitos estimulan tanto la angiogénesis como la proliferación celular.
- Aumento del suministro sanguíneo al área afectada: numerosas sustancias salen de las células lesionadas, de los vasos sanguíneos o de sus compartimientos naturales. Se trata de proteínas del tipo de la histamina, serotonina, sistema de cininas y proteínas séricas. Estas sustancias producen estímulos que modifican la actividad y la permeabilidad vascular en el lado venoso de los capilares. El efecto máximo de las aminas es de breve duración; para la histamina no es mayor de 30 minutos.
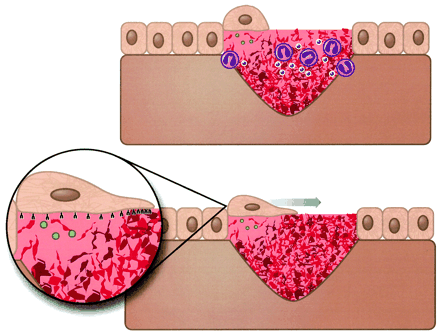
Fase proliferativa
La inflamación representa una función de limpieza y preparación, en tanto que la proliferación reconstruye, por lo que las fases no tienen una división cronológica y ocurren de manera conjunta y armónica, aunque, como en un incendio, no es posible reconstruir cuando todavía no se apaga el fuego. Al igual que la inflamación, la proliferación celular tiene elementos fundamentales.
- Epitelización: la respuesta de las células epidérmicas inicia dentro de las primeras 24 h de sufrida la lesión. A las 12 h de perder contacto con sus homólogos vecinos, los queratinocitos de los bordes de la herida y de los folículos pilosos o de las glándulas sebáceas se aplanan, forman filamentos de actina en su citoplasma, emiten prolongaciones semejantes a seudópodos y emigran. Las células epiteliales son capaces de emigrar sobre las moléculas de colágena, y su mitosis tiene lugar bajo estímulo de factores de crecimiento epidérmico que son, además, importantes mitógenos de la proliferación celular. La mitosis tarda más en iniciar que la migración, por lo general de 48 a 72 horas después de la lesión. Las células se multiplican y movilizan hasta que entran en contacto con otras células epiteliales, momento en el cual se inhiben. Entonces las células toman una apariencia similar a la que tuvieron en condiciones basales y, a medida que maduran, forman queratina. La queratina es la sustancia orgánica que forma la base de la epidermis, uñas, cabello y tejidos córneos. Cuando las células epiteliales dejan de migrar se inicia la reconstrucción de la membrana basal, que consiste en la formación de un gran número de complejos de adhesión ligados a la red colágena, formando hemidesmosomas y depositando los componentes proteínicos como la colágena IV y la laminina V, más adelante se secreta colágena VII, que fi ja las estructuras fibrilares. La integridad de la membrana basal es esencial para la fijación de la epidermis a la dermis, y cuando esto no se ha reconstituido, la fijación de la nueva epidermis es inestable.
- Angiogénesis: el término “angiogénesis” se utiliza para designar la proliferación de nuevos vasos o neovascularización, o bien, el flujo local de células endoteliales. Los monocitos y los macrófagos producen factores que inducen la formación de nuevos vasos por los que se transporta oxígeno y nutrientes a la herida, y secretan sustancias biológicamente activas, estimulados por la baja tensión de oxígeno tisular resultante de la lesión, la presencia de ácido láctico y aminas biógenas. Los nuevos vasos se originan como capilares que brotan a los lados de los pequeños vasos a manera de respuesta a los factores angiógenos; emiten seudópodos a través de la lámina basal y se proyectan al espacio perivascular. Después se dividen, se forman vacuolas y se fusionan para crear un nuevo lumen.
- Matriz de la herida (sustancia fundamental): el tejido herido no sólo está formado por células; también es preciso considerar el espacio extracelular, el cual está lleno de macromoléculas que forman una matriz compuesta por proteínas fibrosas embebidas en gel de polisacáridos, hidratados y secretados por los fibroblastos. Las proteínas fibrosas tienen dos funciones: algunas son importantes para la estructura, como la colágena y la elastina; en tanto que otras son adhesivas, como la fibronectina y la laminina. Las fibras mantienen la unión y las proteínas adhesivas ayudan a mantener fijas las células entre sí. La fibronectina es una proteína a la que se adhieren muchas moléculas y macromoléculas; es un punto de apoyo de los fibroblastos. La laminina es parte de la lámina basal que promueve los ligandos de las células epiteliales. Los proteoglucanos están compuestos por una proteína a la que están unidos polisacáridos en covalencia.
- Fibroplasia y síntesis de colágenas: los macrófagos activados estimulan a las células primordiales que están en reposo y que se localizan de manera predominante a lo largo de los vasos más pequeños; estas células indiferenciadas pueden proliferar con rapidez bajo el estímulo y transformarse en las células esenciales de la reparación tisular: versátiles fibroblastos con capacidad para sintetizar las proteínas especializadas de la cicatrización; miofibroblastos con capacidad contráctil y, en algunos lugares, condroblastos y osteoblastos. Los fibroblastos son células altamente especializadas que el estudiante debe distinguir con claridad de los fibrocitos, los cuales son células en reposo sin funciones mayores de síntesis. 72 horas después de ocasionada la herida, y son estimulados y regulados por factores quimiotácticos complejos que provienen de los macrófagos presentes en la herida. Son los protagonistas de la proliferación y, junto con los nuevos vasos y la matriz, forman el tejido llamado de “granulación”, el cual constituye uno de los signos macroscópicos más objetivos y esperados en la evolución de la herida hacia la cicatrización. Los fibroblastos aparecen entre 48 y 72 horas después de ocasionada la herida, y son estimulados y regulados por factores quimiotácticos complejos que provienen de los macrófagos presentes en la herida. Son los protagonistas de la proliferación y, junto con los nuevos vasos y la matriz, forman el tejido llamado de “granulación”, el cual constituye uno de los signos macroscópicos más objetivos y esperados en la evolución de la herida hacia la cicatrización.
- Contracción de la herida: la contracción de la herida es el mecanismo biológico por medio del cual las dimensiones de una herida extensa y no suturada disminuyen durante la cicatrización. Es una disminución gradual del área de la herida por retracción de la masa central del tejido de granulación. Las fuerzas contráctiles producidas por este tejido son resultado de la acción de los miofibroblastos que contienen proteínas contráctiles y que se han considerado de manera morfológica y fisiológica una transición entre el fibroblasto y el músculo liso.

Fase de remodelación
Cuando ha sido reparada la rotura de la continuidad de los tejidos, el estímulo angiógeno disminuye en intensidad y, al parecer, como respuesta a las tensiones elevadas de oxígeno en los tejidos se inicia un periodo en el que la herida madura, la cual presenta remodelación morfológica, también disminuyen la hiperemia y su vascularidad, asimismo se reorganiza el tejido fibroso neoformado. A esto se le llama fase de remodelación y consiste en el descenso progresivo de los materiales formados en la cicatriz, así como en los cambios que experimenta con el tiempo. Las macromoléculas dérmicas como la fibronectina, el ácido hialurónico, los proteoglucanos y la colágena funcionan como andamio para la migración celular y soporte de los tejidos. Su degradación y remodelación forman un proceso dinámico que continúa mucho tiempo después de que se restaura la continuidad de la piel. Alrededor de 42 días después de la lesión, la cicatriz contiene el total de la colágena que ha de acumular, y por varios años sus propiedades físicas como color, tamaño y flexibilidad, mejoran desde el punto de vista de la función y el aspecto. Este fenómeno es resultado de modulaciones en el tipo de colágena contenida en la cicatriz. La colágena que más se deposita es del tipo III y, durante un año o más, la dermis en la herida regresa a un fenotipo más estable que consiste en colágena tipo I. En el proceso se hacen cambios de orientación de las fibras, en los que por lo general se preservan las que están orientadas en forma paralela a las líneas de tensión. La remodelación representa un equilibrio entre síntesis y degradación, que se efectúa por medio de enzimas entre las que destacan la hialuronidasa, los activadores del plasminógeno, las colagenasas y las elastasas.
En los siguientes videos se explica un poco más a detalle las fases de la cicatrización.
Factores que retardan la cicatrización
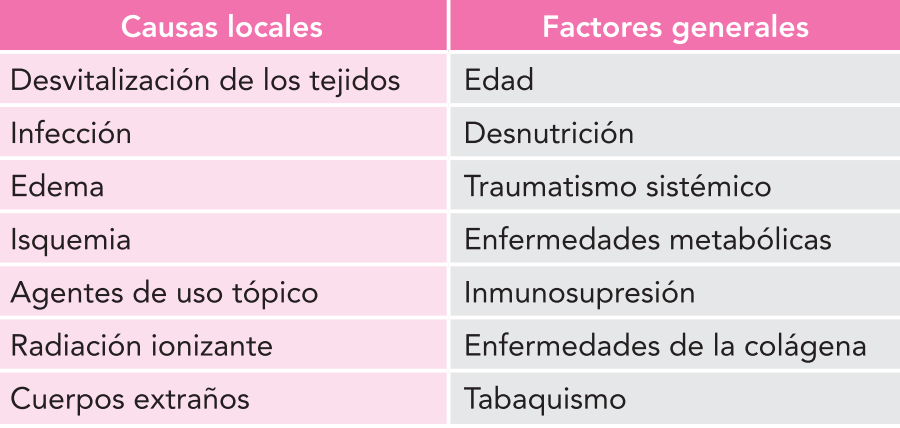
La infección es una de las causas más comunes de retraso en la cicatrización, además de que favorece la formación de úlceras crónicas en especial cuando la presencia de algún material de sutura o cuerpo extraño estimula en forma permanente la multiplicación bacteriana, la cual provoca una lesión conocida como granuloma piógeno. La disminución del aporte sanguíneo causada por las
enfermedades arteriales obstructivas de los vasos de mediano y pequeño calibres obstaculiza la hiperemia necesaria para la curación e impide la llegada de nutrientes por el contrario, las obstrucciones venosas producen éxtasis en la circulación con hipoxemia tisular.
Los defectos en la técnica quirúrgica, por ejemplo,
cuando se introduce material de sutura en exceso o no se extraen los cuerpos extraños, son otras causas de interferencia. Cuando quedan en la herida tejidos desvitalizados por la exposición prolongada y el traumatismo, aumentan las posibilidades de que se convierta en medio de cultivo en el que se desarrollen las infecciones y se prolongue en forma innecesaria la primera fase de la cicatrización.
La edad en sí no es factor que retrase el proceso cicatricial, pero se sabe que en los ancianos el proceso es más lento, tanto en la fase inflamatoria como en la proliferativa, además de que las enfermedades que pueden afectar la cicatrización tienen más prevalencia en los ancianos que en los adultos o en los jóvenes. Las carencias nutricionales crónicas inhiben el proceso cicatricial; el mecanismo más conocido es la disminución de las proteínas séricas esenciales para producir las proteínas de la cicatrización, el cual también interviene con frecuencia en la génesis de las úlceras crónicas de los pacientes encamados durante mucho tiempo. Asimismo, la desnutrición crónica está acompañada de la disminución de otros elementos necesarios para la cicatrización, como la vitamina C y el zinc. La deficiencia de vitaminas A, B, K y E suele acompañar a los estados de desnutrición, e interfiere de modo importante en la reparación fisiológica de los tejidos.